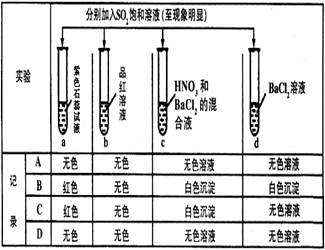
摘要:本文介绍了钒离子的结构示意图及其相关性质。钒离子具有多种价态,其结构示意图表现出其电子排布的特点。钒离子还具有良好的催化性能、热稳定性和化学稳定性等性质,在化学、材料科学、冶金等领域具有广泛的应用。本文简要概述了钒离子的基本性质和特点,为读者提供了有关钒离子的基础知识。
本文目录导读:
钒(Vanadium)是一种重要的金属元素,位于元素周期表的第四周期,拥有多种氧化态和离子形态,钒离子在化学、材料科学、冶金等领域具有广泛的应用,本文将详细介绍钒离子的结构示意图以及相关性质,为读者提供一个全面的认识。
钒离子的基本性质
钒的原子序数为23,电子构型为[Ar]3d34s2,在化学过程中,钒可以失去最外层的电子形成钒离子,常见的钒离子有V2+、V3+和V4+等,钒离子的化学性质与其氧化态有关,不同的氧化态具有不同的电子排布和化学反应性。
钒离子结构示意图
钒离子结构示意图主要描述了钒原子失去电子后的核外电子排布情况,以下分别介绍V2+、V3+和V4+的示意图:
1、V2+离子结构示意图:当钒原子失去两个电子时,形成V2+离子,其核外电子排布为[Ar]3d3,即3d亚层有3个电子,没有s亚层电子,示意图中,圆圈表示原子核,圆圈外的电子表示外层电子排布。
2、V3+离子结构示意图:当钒原子失去三个电子时,形成V3+离子,其核外电子排布为[Ar]3d2,示意图中,显示出原子核周围的电子云分布情况。
3、V4+离子结构示意图:当钒原子失去四个电子时,形成V4+离子,其核外电子排布为[Ar]3d1,示意图中,清晰地展示了离子的电子构型。
钒离子的相关性质
1、离子半径:随着电荷的增加,钒离子的半径会发生变化,电荷越高,半径越小,这是因为电荷的增加会导致离子周围的电子云收缩,从而使半径减小。
2、化学性质:钒离子的化学性质与其氧化态密切相关,不同氧化态的钒离子具有不同的反应性和配位能力,V4+具有较强的氧化性,而较低氧化态的钒离子则具有较强的还原性。
3、化合物性质:钒离子可以形成多种化合物,如氧化物、硫化物、卤化物等,这些化合物的性质与钒离子的氧化态和配位环境有关,五氧化二钒(V2O5)是一种重要的催化剂和颜料。
4、应用领域:钒离子在化学、材料科学、冶金等领域具有广泛的应用,在钢铁行业中,钒被用作合金元素,以提高钢材的强度、韧性和耐磨性,钒还广泛应用于催化剂、电池、光学等领域。
本文详细介绍了钒离子的基本性质、结构示意图以及相关应用,通过了解钒离子的性质和应用,我们可以更好地认识钒的重要性及其在各个领域的应用价值,随着科学技术的不断发展,钒离子有望在更多领域发挥重要作用。
展望
尽管我们已经对钒离子的性质和应用有了较为全面的了解,但随着科学技术的不断进步和研究的深入,钒离子的许多新性质和潜在应用仍待发掘,在新能源领域,钒离子可能作为电池材料的候选者,为能源存储和转换提供新的解决方案,在催化剂、纳米材料、生物医学等领域,钒离子也可能展现出新的应用前景,为了推动钒离子的研究和应用发展,我们需要进一步加强基础研究,深入了解其电子结构、化学反应性和配位化学等方面的性质,还需要加强跨学科合作,结合不同领域的技术和方法,共同推动钒离子的研究和应用创新,钒离子在未来的科学研究和技术应用中具有广阔的前景和潜力,我们期待未来钒离子能在更多领域发挥重要作用,为人类的科技进步和生活改善做出更大的贡献。

 京公网安备11000000000001号
京公网安备11000000000001号 京ICP备11000001号
京ICP备11000001号
还没有评论,来说两句吧...